初回のサイエンス記事では私が研究している創薬ターゲット分子であるGasdermin D(GSDMD)について解説しました。
GSDMDが炎症反応を引き起こすメカニズムは現在進行形で明らかとされつつあります。
先日、Nature Immunology という雑誌に面白い最新論文が発表されたので記事にしたいと思います。
炎症性物質の種類(サイトカイン、アラーミン)
前回の記事で炎症性物質が炎症を引き起こすのに必要であることを説明しました。
炎症性物質として有名なものは“炎症性サイトカイン”とよばれるインターロイキン(IL)やインターフェロンなどの物質があります。
例えば、前回の記事でも出てきたIL-1βは、最初は”Pyrogen”(“Pyro” はギリシャ語で“炎“でしたよね。)、つまり炎症を起こす物質として随分と昔に発見されています。(1984年にヒトIL-1βのcDNAをクローニングしていた(1)というのがすごい。。)
他にもアラーミン(Alarmin)とよばれるような物質があります。これば文字通り、体にアラーム(警告)を起こす物質で、通常は細胞内にあってストレス負荷や組織の破壊などが起こると放出され、炎症を知らせるようなものがあります。
例えば、有名なものとしてHigh Mobility Group Box – 1(HMGB1)というものがあります。HMGB1は通常、細胞の核内にあってクロマチン構造の維持機能や転写活性調節など様々な役割をしていますが、刺激によって細胞外に放出されて炎症を惹起する物質としても知られています。
これら炎症性物質が放出されるメカニズムはどうなっているのでしょうか?
炎症性物質が放出されるメカニズム
通常、細胞内から細胞外に放出されるタンパク質(シグナル分泌タンパク質)には、そのN末端にシグナルペプチド配列があります。このシグナルペプチドを目印としてタンパク質は通常の分泌経路(小胞体→ゴルジ体→細胞外)から分泌されることがわかっており、細胞生物学の教科書にも載っていますね。
実は炎症性サイトカインのほとんど(TNF-αやIL-6)はこのシグナルペプチドを持っているので通常の分泌経路を使って細胞外に放出されます。
しかし、一部のタンパク質はシグナルペプチド配列を持たないのに細胞外に出ているものがあります。
例えば、IL-1β。IL-1βは炎症性サイトカインなので細胞外で機能を発揮しますが、シグナルペプチド配列はありません。IL-1βは非常に有名で重要な炎症性サイトカインなのにも関わらず、発見から30年以上経ってからも分泌経路が完全に解明されていませんでした。
これらのタンパク質はどのような分泌経路で細胞外に出ているのでしょうか?
実は現在でも様々な研究者がそのメカニズムを研究しています。
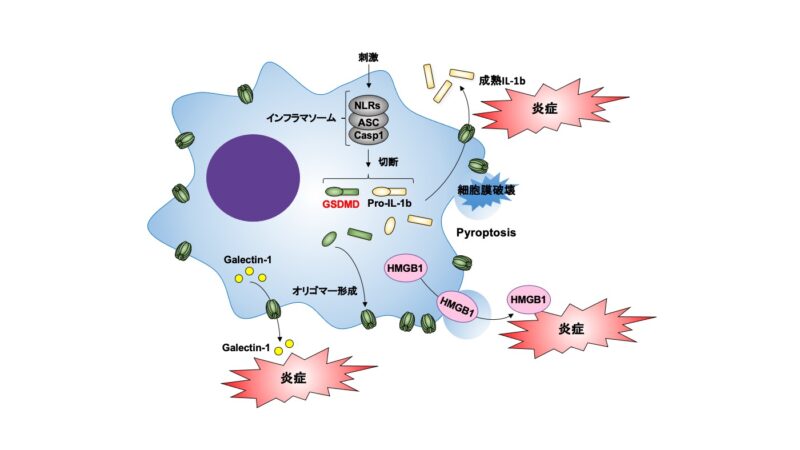
オートファジー、分泌リソソーム、ABCトランスポーター、細胞死の関与など、様々な仮説が議論されていますが、現在、サイエンスのコミュニティーで受け入れられているメカニズムの一つとして、GSDMDの関与が注目されつつあります。
以前にも解説しましたがGSDMDは細胞膜に穴を開けることができます。その穴の大きさは10 – 20 nm 程度だとわかっているので、IL-1βなどの一部の小さなタンパク質はGSDMDの穴から外に出ることができるのです(2)。
しかも、この状態ではまだ穴が空いていますが細胞が生きています。GSDMDによって細胞膜に穴は空いてもESCRT-III依存的な細胞膜の修復機構で元の状態に戻ることもできます(3)。つまり、生きた状態の細胞がIL-1βを分泌しているのです(4)。
一方、GSDMDによって穴の空いた細胞の中でも、膜構造の修復が追いつかなければいずれ細胞膜が破壊されるので、結果として炎症性の細胞死(Pyroptosis)を起こしてしまいます。HMGB1などのGSDMDの穴よりも大きなタンパク質は、細胞死が起こると同時に外に漏れ出すように分泌されることがわかってきました(5)。
Galectin-1とその役割
今回の論文は、新たな炎症性物質としてGalectin-1というものを取り上げ、GSDMDの穴から放出されることを明らかにした内容です。また、Galectin-1が炎症性物質として機能することを示しています。データが膨大なので大切だと思う一部だけを抜粋します。
Galectin-1はシグナルペプチドを持たないタンパク質ですが、細胞外に分泌することがわかっています。しかし、その分泌メカニズムは謎のままでした。
筆者らは質量分析の実験系で、まずはGalectin-1を同定。炎症の刺激を加えたGSDMDノックアウト細胞(マクロファージ)と野生型細胞を比較し、GSDMDノックアウトマクロファージからGalectin-1の分泌が抑えられていることを明らかとしました。
この際、Galectin-1の分子量が14.5 kDaと小さいことからGSDMDの穴から分泌されることを証明しています。
また、敗血症患者におけるヒト血清中のGalectin-1が、健常者と比べて高い値を示していることを明らかにしています。敗血症はLPS投与によるマウスモデルにおいてGSDMD特異的に起こることがわかっている疾患の一つなので理にかなった結果ですね。
さらにGalectin-1のノックアウトマウスを用いてLPS投与による敗血症を誘導する実験もしています。LPS投与によるマウス敗血症モデルはサバイバルを指標にしており、Galectin-1のノックアウトマウスは野生型マウスと比べてより多くのマウスが生き残ることが明らかとなっています。
最後に
これまで、GSDMD依存的に分泌される炎症性物質としてIL-1βとHMGB1などが知られていました。今回、新たにGalectin-1が分泌されることが明らかとなり、それが炎症性疾患に関与していることが示唆されました(6)。
実はIL-1βは、通常pro-IL-1βとして細胞質に発現しています。pro-IL-1βは分子量約31 kDaとそこまで小さくないので、pro-IL-1βの状態ではGSDMDの穴を通過できません。
しかし、インフラマソームが活性化してCaspase-1が活性化するとpro-IL-1βを切断し、成熟したIL-1βとなります。成熟したIL-1βは分子量約17 kDaと小さいのでGSDMDの穴から分泌されることができるのです。
今回のGalectin-1はもともと分子量が小さいので、切断などのプロセスが不要な物質です。このようなプロセス不要でGSDMDに依存的に分泌される小さい分子は初めての報告だと思います。
少し調べてみると、Galectin Therapeuticsという、Galectin(Galectin-1およびGalectin-3)をターゲットにして阻害剤を開発しているスタートアップがありました。
Belapectin (GR-MD-02) というgalectin-1とgalectin-3に結合する阻害剤を開発中で、様々な疾患に対するクリニカルトライアルを行なっているようです。
| Product Name | Targets | Standard Indication | Phase of Development |
| Belapectin, galactoarabino-rhamnogalacturonate (GR-MD-02) | Galectin-3 (LGALS3); Galectin-1 (LGALS1) | Head and neck cancer | Phase I |
| Belapectin, galactoarabino-rhamnogalacturonate (GR-MD-02) | Galectin-3 (LGALS3); Galectin-1 (LGALS1) | Melanoma | Phase I |
| Belapectin, galactoarabino-rhamnogalacturonate (GR-MD-02) | Galectin-3 (LGALS3); Galectin-1 (LGALS1) | Non-small cell lung cancer (NSCLC) | Phase I |
| Belapectin, galactoarabino-rhamnogalacturonate (GR-MD-02) | Galectin-3 (LGALS3); Galectin-1 (LGALS1) | Psoriasis | Phase II |
| Belapectin, galactoarabino-rhamnogalacturonate (GR-MD-02) | Galectin-3 (LGALS3); Galectin-1 (LGALS1) | Dermatitis | Phase II |
| Belapectin, galactoarabino-rhamnogalacturonate (GR-MD-02) | Galectin-3 (LGALS3); Galectin-1 (LGALS1) | Liver fibrosis | Phase II/III |
| Belapectin, galactoarabino-rhamnogalacturonate (GR-MD-02) | Galectin-3 (LGALS3); Galectin-1 (LGALS1) | Non-alcoholic steatohepatitis (NASH) | Phase II/III |
| Belapectin, galactoarabino-rhamnogalacturonate (GR-MD-02) | Galectin-3 (LGALS3); Galectin-1 (LGALS1) | Pulmonary fibrosis | Preclinical |
また、彼らのサイトによるとGalectinはマクロファージに高発現しているようです。今回の論文もマクロファージを使っており、内容も合致していますね。
今後、Galectinの新たな機能、またその阻害剤に関する新しい報告に注目していきたいです。
References
- Auron et al. PNAS 1984 Nucleotide sequence of human monocyte interleukin 1 precursor cDNA
- Sborgi, et al. EMBO 2016 GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death
- Rühl et al. Science 2018 ESCRT-dependent membrane repair negatively regulates pyroptosis downstream of GSDMD activation
- Evavold et al. Immunity 2018 The Pore-Forming Protein Gasdermin D Regulates Interleukin-1 Secretion from Living Macrophages
- Volchuk et al. Nat Commun. 2020 Indirect regulation of HMGB1 release by gasdermin D
- Russo et al. Nat Immunol. 2021 Intracellular immune sensing promotes inflammation via gasdermin D–driven release of a lectin alarmin


